
全基因组测序可挖掘DNA水平的遗传变异,包括较大的结构变异。测序周期短,数据覆盖均一,可用于拷贝数变异和结构变异的检测、融合基因检测、病毒整合位点检测、非编码区突变检测。为筛选疾病的致病及易感基因,研究发病及遗传机制,以及推断种群进化等提供重要信息。
方案设计
全基因组测序在基因组的编码区和非编码区对致病突变位点/基因进行筛选或预测,与外显子测序相比, 能够发现更多大的结构变异。全基因组测序同样根据疾病的类型及特点进行取样并设计测序及分析策略。
在标准分析之外,派森诺生物提供多种个性化分析项目。
测序深度
个体基因组研究30~100×,大量样本的群体基因组研究至少10×。
相关研究
病 种 | 期 刊 | 影响因子 | 深 度 | 时 间 |
胰腺神经内分泌肿瘤1 | Nature | 41.456 | 38X(正常) 61X(肿瘤) | 2017 |
乳腺癌2 | Nature | 41.456 | 30.2X(正常) 40.4X(肿瘤) | 2016 |
宫颈癌3 | Nature Genetics | 29.352 | 30X | 2015 |
前列腺癌4 | Nature | 41.456 | 55X | 2015 |
胰腺癌5 | Nature | 41.456 | 65× | 2015 |
1、Scarpa A, Chang D K, Nones K, et al. Whole-genome landscape of pancreatic neuroendocrine tumours.[J]. Nature, 2017, 543(7643):65.
2、Nikzainal S, Davies H, Staaf J, et al. Landscape of somatic mutations in 560 breast cancer whole genome sequences[J]. Nature, 2016, 534(7605):47.
3、Hu Z, Zhu D, Wang W, et al. Genome-wide profiling of HPV integration in cervical cancer identifies clustered genomic hot spots and a potential microhomology-mediated integration mechanism.[J]. Nature Genetics, 2015, 47(2):158.
4、Gundem G, Loo P V, Kremeyer B, et al. The evolutionary history of lethal metastatic prostate cancer[J]. Nature, 2015, 520(7547):353-7.
5、Waddell N, Pajic M, Patch A M, et al. Whole genomes redefine the mutational landscape of pancreatic cancer[J]. Nature, 2015, 518(7540):495.
技术路线
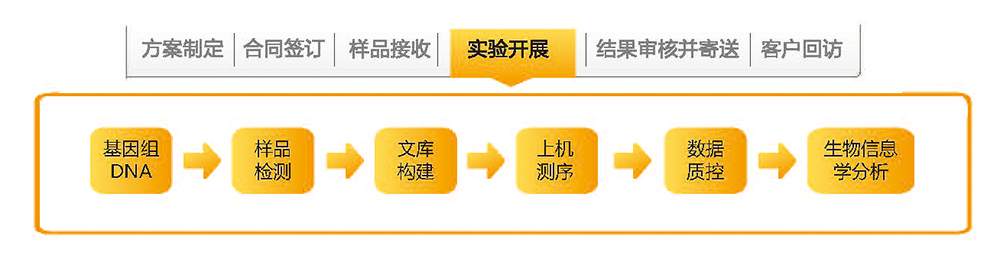
1. 基因组DNA:DNA浓度≥20 ng/μl,总量≥2μg; OD 260/280介于1.8-2.0之间,电泳检测无明显RNA条带,基因组条带清晰、完整。DNA无污染、无降解。
2. 血液样品:采集新鲜血液2-3ml于含有EDTA的抗凝管中(紫色盖子),封口处用封口膜密封,样品保存在-20℃冰箱,冰袋运输。
3.人类组织样本
3.1.新鲜组织:手术新鲜组织黄豆大小2-3个/穿刺组织长度至少1cm,2-3条,置于冷冻管内并于-80℃及以下保存(可保存一年),并于冷冻状态运输;
3.2.蜡块:2年以内标准程序制备的石蜡块,蜡块中组织体积大于1 cm3,室温储存及运输。
3.3.石蜡组织切片-白片:2年以内标准程序制备的石蜡组织切片,未染色的白片,厚度:5-10µm,表面积大于1cm2,10片及以上(如切片厚度或表面积达不到要求需按比例增加切片数量),室温储存及运输。
4. 样品保存期间切忌反复冻融。
分析内容及结果
A: 标准分析 | ||
类别 | 分析内容 | |
1.1 | 数据质控 | |
1.1.1 | 下机数据统计 | |
1.1.2 | 数据质量查看 | |
1.1.3 | 数据获取 | |
1.2 | 序列比对 | |
1.2.1 | 参考序列比对 | |
1.2.2 | 序列比对结果概述 | |
1.2.3 | 目标区域测序深度及覆盖度概述 | |
1.3 | 变异检测 | |
SNP | ||
1.3.1 | SNP检测 | |
1.3.2 | SNP注释及统计 | |
1.3.3 | SNP突变频谱分析 | |
1.3.4 | SNP碱基偏好分析 | |
1.3.5 | SNP在外显子的分布 | |
INDEL | ||
1.3.6 | InDel检测 | |
1.3.7 | InDel注释及统计 | |
1.3.8 | InDel在外显子的分布 | |
1.3.9 | InDel片段长度统计 | |
CNV | ||
1.3.10 | CNV检测,统计 | |
SV | ||
1.3.11 | SV检测,统计 | |
变异位点筛选 | ||
1.3.12 | 高频突变分析 | |
1.3.13 | 突变有害性分析 | |
B: 个性化分析 | |||
类别 | 分析内容 | 备注 | |
2.1 | 多样本变异位点异同分析 | ||
2.1.1 | 多样本分组组间异同分析 | 至少2组,每组≥3个样本 | |
2.1.2 | 多样本共有突变筛选 | 样本数≥3 | |
2.2 | 致病候选基因筛查预测 | ||
2.2.1 | 孟德尔遗传病-致病基因分析 | 家系样本采样要求: | |
2.2.2 | 复杂疾病-致病候选基因预测 | 采样要求:单个大家系要求尽可能选取所有的患病样本,多个小家系要求每个家系患病样本数目至少≥3, | |
2.2.3 | 复杂疾病-已知易感基因筛查 | ||
2.3 | 新生突变筛选及分析 | ||
2.3.1 | De novo mutations筛选(DNMs) | 采样要求:对于单个家系:子代+双亲,样本数目至少≥3(成3取样),也可以加上兄弟姐妹的样本(成4取样),多个家系进行研究时候建议对同种疾病(同种亚型)的家系进行成3或成4取样。 | |
2.3.2 | DNMs 频谱分析 | ||
2.3.3 | 新生突变率计算 | ||
2.4 | 候选基因富集分析 | ||
2.4.1 | 候选基因GO功能富集分析 | ||
2.4.2 | 候选基因DO疾病富集分析 | ||
2.6.3 | 候选基因KEGG通路富集分析 | ||
2.5 | 调控网络分析 | ||
2.5.1 | 蛋白互作网络分析(PPI) | ||
2.6 | 肿瘤基因组分析 | 基本要求:Tumor+Normal成对取样,样本数目至少≥2,样本信息,疾病信息 | |
驱动基因/致病机理分析 | |||
2.6.1 | 肿瘤突变负荷分析(TMB) | 信息要求:样本信息,肿瘤信息 | |
2.6.2 | 肿瘤驱动基因预测 | 样本数目至少≥3,能达到几十或者上百,要求同一癌症类型的成对癌组织或者血液 | |
2.6.3 | 肿瘤已知驱动基因筛查 | ||
易感基因分析 | |||
2.6.4 | 肿瘤易感基因筛查 | 1个或者多个遗传性癌症家系样本,家系内选取多位患者癌组织(或血液)及其它正常组织(或血液) | |
异质性分析 | |||
2.6.5 | 肿瘤杂合性缺失分析 | ||
2.6.6 | 肿瘤纯度分析 | ||
2.6.7 | 肿瘤倍性分析 | ||
2.6.8 | 肿瘤异质性---克隆结构分析 | ||
2.6.9 | 肿瘤异质性---克隆进化分析 | 同一患者不同时间段,不同部位取样,或者多个患者肿瘤组织和正常组织的成对取样 | |
病毒整合分析 | |||
2.6.10 | 病毒序列识别 | ||
2.6.11 | 整合位点/热点检测 | 样本数目至少≥30 ,病毒血清学检测阳性的同一癌种患者,Tumor+Normal成对取样 | |
2.6.12 | 整合机制分析 | ||
2.7 | 个性化图形展示 | ||
2.8 | 临床数据整合分析 | ||
部分分析结果展示
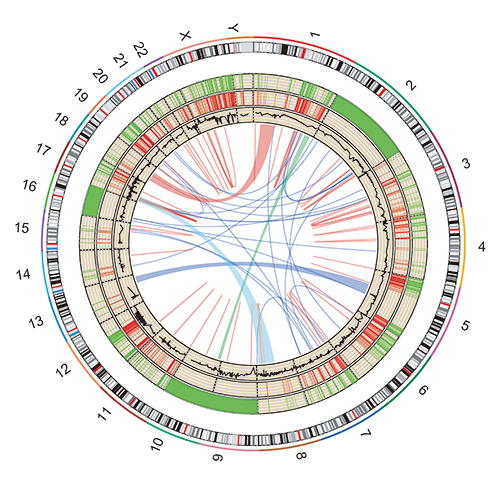
变异可视化分析
通过Circos对测序变异位点进行可视化分析,最外圈为染色体区带,从外到内依次为SNP、InDel、CNV、SV在染色体中的分布。
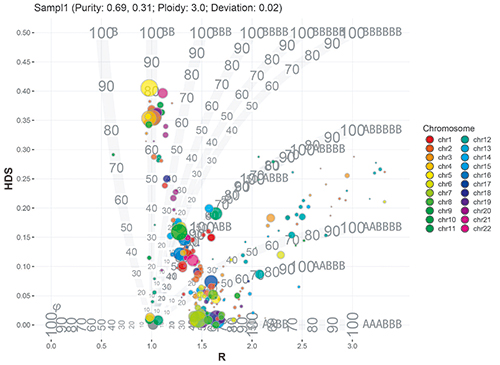
肿瘤异质性分析
Bubble树图能直观地展现肿瘤的纯度、克隆性及倍型情况。横坐标表示肿瘤的倍型,纵坐标反应了肿瘤的异质化程度。
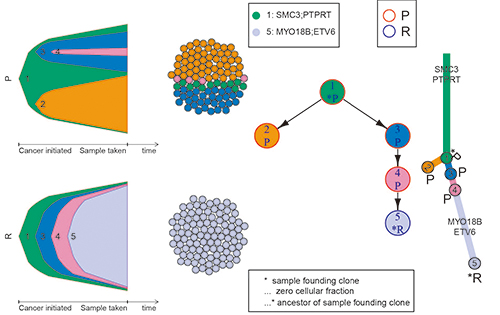
肿瘤亚克隆结构与进化分析:展示了两个不同阶段肿瘤样本随着时间的推移瘤内结构变化及进化情况。
细胞群为某个时间点肿瘤样本的结构组成,右边的分支图显示了相关的驱动基因及肿瘤的进化过程。
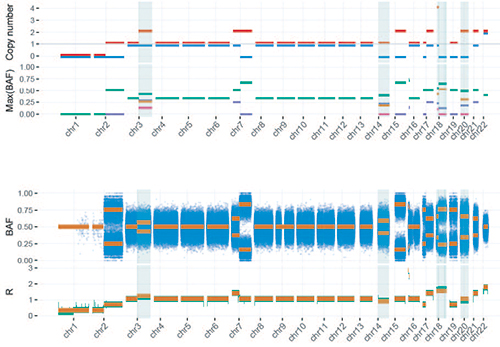
染色体拷贝数分布及等位基因变异频率分析:其中R代表肿瘤样本与正常样本的拷贝率,BAF( B allele frequency ),代表等位基因变异频率。
Q:人全基因组测序的优势是什么?
A:人全基因组测序可以挖掘各种遗传变异,一些大的结构变异,与全外显子测序相比,不局限于编码区变异,可以在全基因组范围内寻找与疾病或功能相关的位点。
Q:人基因组测序一般推荐多少测序深度?
A:30X测序深度即可鉴定大部分SNP;综合考虑SNV、编码区外显子、基因组基因型变异检出率,建议选择60X平均测序深度;如果研究目的是寻找肿瘤细胞携带的低丰度突变、疾病研究中低频或者罕见变异,或者癌组织中较大的结构变异,建议选择更高的深度。群体重测序可根据群体分析策略寻找相关变异,低深度即可(4X-12X),因此,根据研究目的、样本量及研究者的预期对测序深度进行选择。
- 购买人 会员级别 数量 属性 购买时间
- 商品满意度 :
-








